PUBLICIDADE
As reações de oxirredução que ocorrem com a presença da água oxigenada (solução aquosa de peróxido de hidrogênio – H2O2(aq)) constituem um caso especial que deve ser analisado separadamente, principalmente quanto ao seu balanceamento. Isso acontece porque os oxigênios da água oxigenada, que têm Nox igual a -1, tanto podem se oxidar, como se reduzir.
Por exemplo, vejamos dois casos em que ela se comporta primeiro como agente oxidante (se reduzindo) e depois como agente redutor (se oxidando):
- Agente oxidante: sempre que a água oxigenada se reduz, agindo como agente oxidante, ela gera água como produto.
Se adicionarmos uma solução de água oxigenada a uma solução contendo íons iodeto (I-) em meio ácido, teremos:
H2O2(aq) + I-(aq) +H+(aq) → H2O(l) + I2(s)
Veja que se formou água e iodo. Mas para conferir se a água oxigenada atuou realmente como agente oxidante e se reduziu, observe a determinação dos números de oxidação (Nox):*

O Nox do oxigênio da água oxigenada diminuiu de -1 para -2, sendo que ele recebeu 1 elétron. Porém, como temos dois oxigênios em cada molécula de água oxigenada (H2O2), a variação do Nox será igual a 2.
Assim, conforme mostrado no texto “Balanceamento por oxirredução”, um passo necessário para se balancear as reações pelo método de oxirredução é inverter os valores das variações dos Nox pelos coeficientes, ficando, nesse caso, da seguinte forma:
* H2O2 = 2 (∆Nox) = 2 → 2 será o coeficiente do I-;
* I-= ∆Nox = 1 → 1 será o coeficiente do H2O2.
Desse modo, temos:
1 H2O2(aq) + 2 I-(aq) + H+(aq) → H2O(l) + I2(s)
Acertando os demais coeficientes pelo balanceamento por tentativas:
- Visto que há dois átomos de oxigênio no 1º membro, o coeficiente da água no 2º membro terá que ser igual a 2. E como existem também dois íons iodeto no 1º membro, o coeficiente do iodo no 2º membro será 1. Não se esqueça de que temos que multiplicar o índice pelo coeficiente para saber a quantidade correta de átomos e íons em cada membro:
1 H2O2(aq) + 2 I-(aq) +H+(aq) → 2 H2O(l) + 1 I2(s)
- Agora só resta balancear o cátion hidrogênio do 1º membro, sendo que seu coeficiente terá que ser igual a 2, pois no 2º membro tem 4 hidrogênios e no 1º membro já tem dois:
1 H2O2(aq) + 2 I-(aq) +2 H+(aq) → 2 H2O(l) + 1 I2(s)
- Agente redutor: sempre que a água oxigenada se oxida, agindo como agente redutor, ela gera oxigênio (O2) como produto.
Um exemplo em que a água oxigenada é redutora é quando ela entra em contato com o permanganato de potássio (KMnO4). Essa substância tem uma cor violeta bastante característica, mas ao entrar em contato com a água oxigenada ela fica incolor. Isso ocorre porque todo manganês presente no íon MnO4- da solução de permanganato é reduzido, originando o íon Mn2+, conforme mostrado a seguir:
+1 -1 +7 -2 +1 0 +2 +1 -2
H2O2 + MnO4-+ H+ → O2 + Mn2++ H2O
Calculando o Nox, vemos que realmente o oxigênio da água oxigenada se oxida e causa a redução do manganês:
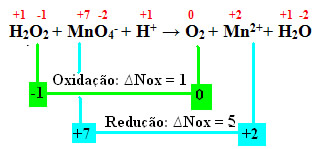
Da mesma forma que no exemplo anterior, o ∆Nox da água oxigenada será igual a 2, pois são dois oxigênios e cada um perde um elétron. Por isso, temos:
* O2 = 2 (∆Nox) = 2 → 2 será o coeficiente do MnO4-;
* MnO4- = ∆Nox = 5 → 5 será o coeficiente do O2.
E como todo O2 é proveniente da água oxigenada, as duas substâncias apresentam o mesmo coeficiente:
5 H2O2 + 2MnO4-+ H+ → 5 O2 + Mn2++ H2O
Balanceando pelo método de tentativas, temos:
5 H2O2 + 2 MnO4-+ 6 H+ → 5 O2 + 2 Mn2++ 8 H2O
* Para esclarecer quaisquer dúvidas sobre como calcular o número de oxidação (Nox) dos átomos e íons de uma reação, leia o texto “Determinação do Número de Oxidação (Nox)”.
Por Jennifer Fogaça
Graduada em Química







