PUBLICIDADE
Radioatividade é a propriedade que alguns átomos, como urânio e rádio, possuem de emitirem espontaneamente energia na forma de partículas e onda, tornando-se elementos químicos mais estáveis e mais leves.
Tópicos deste artigo
- 1 - Tipos
- 2 - Leis
- 3 - Aplicações
- 4 - Radioatividade natural
- 5 - Descoberta
- 6 - Decaimento
- 7 - Elementos radioativos
- 8 - Lixo radioativo
- 9 - Exercícios resolvidos
Tipos
A radioatividade apresenta-se com duas formas diferentes de radiações: partícula — alfa (α) e beta (β); e onda eletromagnética — raios gama (γ).
-
Raios alfa: são partículas positivas constituídas por dois prótons e dois nêutrons e com baixo poder penetração.
-
Raios beta: são partículas negativas que não contêm massa constituídas por um elétron (massa desprezível), e seu poder de penetração é superior ao dos raios alfa, porém inferior ao dos raios gama.
-
Raios gama: são ondas eletromagnéticas de alta energia e, por não serem partículas, também não possuem massa.
Leia também: Fórmulas da radioatividade
Leis
A emissão radioativa de partículas segue determinados comportamentos que são explicados pelas leis da radioatividade (uma para a partícula alfa e outra para a partícula beta), que foram descritas pelo químico inglês Frederick Soddy e pelo químico e físico polonês Kazimierz Fajans.
-
Primeira lei da radioatividade
Segundo essa lei, quando um átomo radioativo emite uma radiação do tipo alfa, ele dará origem a um novo átomo com núcleo contendo dois prótons e dois nêutrons a menos, totalizando uma massa quatro unidades menor. Podemos representar a primeira lei da radioatividade com a seguinte equação genérica:
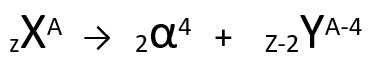
Equação genérica da primeira lei da radioatividade.
Vejamos um exemplo:
![]()
Equação representativa da emissão de partícula α pelo Plutônio-239.
Note que, ao emitir uma radiação alfa, o novo átomo formado, Urânio-235, possui número de massa quatro unidades menor e o número atômico duas unidades menor — exatamente os valores correspondentes à partícula α emitida pelo núcleo do plutônio. Para saber mais sobre, acesse: Primeira lei da Radioatividade ou Primeira Lei de Soddy.
-
Segunda lei da radioatividade
A segunda lei fala sobre a emissão beta. Quando um átomo emite uma partícula beta, constituída por um elétron e de massa desconsiderada, sua massa atômica permanece inalterada e seu número atômico aumenta uma unidade. Genericamente, representamos da seguinte forma:
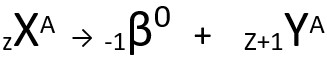
Equação genérica da segunda lei da radioatividade.
Veja o exemplo:
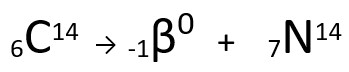
Equação representativa da emissão de partícula β pelo Carbono-14.
Pode-se perceber que o átomo de nitrogênio formado possui a mesma massa do átomo de C-14, ou seja, são isóbaros, e seu número atômico aumenta em uma unidade. O aumento do número atômico foi explicado pelo cientista Henrico Fermi, que propôs que um dos nêutrons do núcleo sofre uma transmutação, segundo a equação seguinte, gerando um elétron (a partícula beta emitida), um neutrino (uma partícula subatômica sem carga elétrica e sem massa, ) e um próton (p).
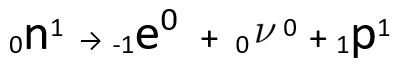
Equação representativa da transmutação do nêutron, segundo a hipótese de Fermi.
O elétron e o neutrino são emitidos para fora do núcleo, permanecendo apenas o próton, o que explica o aumento do número atômico Para saber mais sobre, acesse: Segunda lei da Radioatividade ou Segunda Lei de Soddy.
Leia também: Diferença entre contaminação radioativa e irradiação
Aplicações
Apesar da visão negativa que depositam sobre a radioatividade, ela tem aplicações importantes no nosso cotidiano, por exemplo, na produção de energia elétrica em usinas nucleares por meio da fissão de átomos radioativos.
Atualmente, o Brasil não utiliza a energia nuclear como sua principal fonte de energia, mas possui usinas nucleares (Angra 1 e 2) trabalhando no fornecimento de energia elétrica para o país. Podemos citar também a datação de materiais encontrados por arqueólogos utilizando carbono-14.

Usina nuclear do Rio de Janeiro, Brasil
Outro papel fundamental que a radioatividade possui está relacionado com a área da medicina, como nos exames de raios-X e nas tomografias, e também em alguns tipos de tratamento de câncer.
Leia também: Principais riscos da geração de energia nuclear para o meio ambiente
Radioatividade natural
Diariamente, estamos expostos a pequenas quantidades de radiação, sejam artificiais, sejam naturais. A radioatividade natural dá-se de maneira espontânea na natureza. Parte dessa radiação que recebemos vem dos alimentos consumidos no dia a dia, como o Radônio-226 e o Potássio-40, que se apresentam em níveis muito baixos e não atribuem riscos a nossa saúde e nem prejudicam os valores nutricionais dos alimentos.
Esse processo de expor os alimentos a emissões radioativas tem o objetivo de conservar os alimentos e promover um crescimento das plantas. Alguns exemplos de alimentos que emitem radiação são: castanha-do-pará, banana, feijão, carne vermelha, entre outros.
Descoberta
O estudo da radioatividade teve início com pesquisas do físico alemão Wilhelm Röentgen, em 1895, quando esse investigava o efeito da luminescência. Outro cientista importante para o desenvolvimento da radioatividade foi o físico francês Antoine-Henri Becquerel, que percebeu, em 1896, marcações feitas em um filme fotográfico por uma amostra de sal de urânio.
No entanto, foi o casal Curie que utilizou o termo radioatividade pela primeira vez. Em 1898, a polonesa Marie Curie deu seguimento aos estudos relativos à radioatividade e fez descobertas valiosas para a área, como a descoberta de dois novos elementos radioativos: o polônio (Po) e o rádio (Ra).
Posteriormente, Ernest Rutherford descobriu as radiações do tipo alfa (α) e beta (β), o que permitiu melhores explicações para seu modelo atômico, bem como o avanço das pesquisas relacionadas à radioatividade.
Leia também: Marie Curie: biografia, contribuições e legado
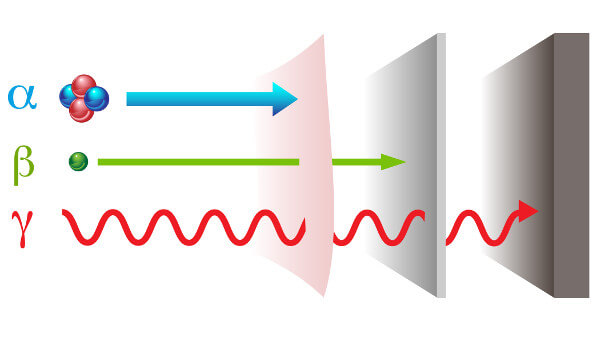
Tipos de radiação e seus poderes de penetração.
Decaimento
O decaimento radioativo (ou transmutação) é o processo natural em que um núcleo instável emite radiação, de forma sucessiva, a fim de diminuir sua energia e tornar-se estável.
Isso ocorre normalmente com átomos de números atômicos maiores que 84, que são átomos com alta instabilidade nuclear devido à quantidade de carga positiva (prótons) acumulada no núcleo. Nesse processo, os nêutrons não são suficientes para estabilizar todos os prótons aglomerados no núcleo, e, então, o núcleo começa a sofrer o decaimento radioativo até que seu número atômico seja menor que 84.
Em alguns casos, pode acontecer que átomos com número atômico inferior a 84 tenham núcleos instáveis e também passem pelo processo de decaimento, mas, para isso, precisam ter um número de prótons bem superior ao número de nêutrons.
O decaimento radioativo é calculado pelo tempo de meia-vida (ou período de semi-desintegração, P) do radioisótopo, que é o tempo necessário para que metade da massa da amostra inicial radioativa sofra desintegração, ou seja, torne-se estável. Graficamente falando, a seguir, está representado o conceito de meia-vida. Por se tratar de um processo contínuo, a curva tende a chegar a zero.
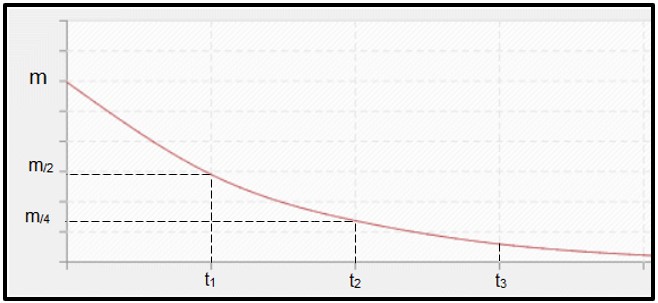
Gráfico representando o tempo de meia-vida.
Os cálculos envolvendo decaimento radioativo seguem as seguintes fórmulas:
-
Fórmula para cálculo da massa restante após o tempo de meia-vida:
![]()
mf – massa final
mo – massa inicial
x – quantidade de meias-vidas decorridas
-
Fórmula para o cálculo do tempo de desintegração de uma amostra radioativa:
![]()
t – tempo de desintegração
P – período de meia-vida
x – quantidade de meias-vidas decorridas
Elementos radioativos
Existem dois tipos de elementos radioativos: os naturais e os artificiais. Os naturais possuem elementos encontrados na natureza, já com seus núcleos instáveis, como o urânio, o actínio e o rádio. Já os artificiais são produzidos por processos que desestabilizam o núcleo de um átomo. Nesse caso, podemos citar o astato e o frâncio.
Os principais elementos radioativos são: urânio-235, cobalto-60, estrôncio-90, rádio-224 e iodo-131. Devido a sua larga utilização em usinas nucleares e tratamentos de câncer, esses elementos tendem a aparecer com maior frequência no nosso cotidiano. Para saber mais sobre esse assunto, acesse: Elementos radioativos.
Lixo radioativo
O lixo radioativo ou lixo nuclear é o resíduo das indústrias que utilizam material radioativo em seus processos que não possuem mais aplicação prática. Esse lixo é oriundo, principalmente, das usinas nucleares e de aplicações médicas.
A grande produção de lixo radioativo tem sido um problema ambiental para todo o mundo, devido às escassas e inadequadas condições de descarte e armazenamento.
Esses rejeitos estão associados à contaminação do solo, dos cursos de água e do ar, resultando na destruição do meio ambiente de forma gradual. Além disso, também causam riscos à saúde humana, como infecções, câncer e, em casos mais severos de contaminação, podem levar à morte.
Exercícios resolvidos
(PUC-Camp-SP) A bomba atômica, também chamada de bomba nuclear, tem como constituinte físsil átomos de urânio-235,![]() , emissores de partículas alfa
, emissores de partículas alfa ![]() . Cada átomo de U-235, ao emitir uma partícula alfa, transforma-se em outro elemento, cujo número atômico é igual a
. Cada átomo de U-235, ao emitir uma partícula alfa, transforma-se em outro elemento, cujo número atômico é igual a
a) 231.
b) 233.
c) 234.
d) 88.
e) 90.
Gabarito: Quando um átomo emite uma partícula alfa ocorre uma diminuição de duas unidades no número atômico, conforme a primeira lei da radioatividade. Portanto: 92-2 = 90. Letra e.
(PUC-Camp-SP) O Iodo-125, variedade radioativa do Iodo com aplicações medicinais, tem meia-vida de 60 dias. Quantos gramas de Iodo-125 restarão após seis meses, com base em uma amostra contendo 2,00 g do radioisótopo?
a) 1,50
b) 0,75
c) 0,66
d) 0,25
e) 0,10
Gabarito: Primeiro, calcula-se o número de meias-vidas decorridos durante os 180 dias:
t = P . x
180 = 60 . x
x = 3
Encontrado o número de meias-vidas decorridas, calcula-se a massa que restará ao final dos 180 dias:
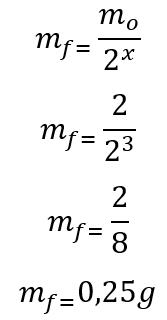
Portanto, restará 0,25g do radioisótopo de Iodo-135 ao final dos seis meses. Letra d.
Por Victor Felix
Graduado em Química






