PUBLICIDADE
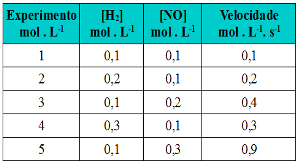
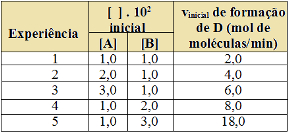
A Lei da Velocidade da Reação relaciona a rapidez de uma transformação química com as concentrações dos reagentes em quantidade de matéria (mol/L), podendo ser enunciada da seguinte forma:

Por exemplo, considere a reação genérica a seguir:
aA + bB → cC + dD
Digamos que nós aumentemos a concentração dos reagentes A e B, o que acontecerá com a velocidade da reação? Bem, como a quantidade de partículas dos reagentes irá aumentar num mesmo espaço, haverá mais choques efetivos entre elas que resultarão no aumento da taxa de desenvolvimento da reação. O que significa que aumentará sua velocidade.
Portanto, a velocidade da reação é diretamente proporcional à concentração dos reagentes. Porém, isso depende da temperatura também. Por isso, temos a seguinte equação matemática que representa a lei da velocidade da reação:

Em que:
v = velocidade da reação;
k = constante que só depende do valor da temperatura;
α e β = expoentes determinados experimentalmente.
Apenas quando a reação é elementar, ou seja, ocorre numa única etapa, é que os expoentes são exatamente iguais aos coeficientes da equação química balanceada: v = k . [A]a . [B]b. Porém, nos outros casos, a potência apropriada à qual se deve elevar a concentração de cada reagente deve ser determinada experimentalmente.
A lei da velocidade das reações recebe muitos nomes, veja alguns: Lei da Ação das Massas, Equação de Rapidez, Lei Cinética da Reação e Lei de Guldberg-Waage.
Considere um exemplo de como aplicar essa lei:
Considere a seguinte reação elementar:
2 HCl (g) → H2(g) + Cl2(g)
a) Escreva a equação de velocidade dessa reação;
b) Por meio de experiências, a velocidade dessa reação de decomposição do gás cloreto de hidrogênio e a concentração desse reagente, em temperatura constante de 25 ºC, foram anotadas na tabela abaixo:
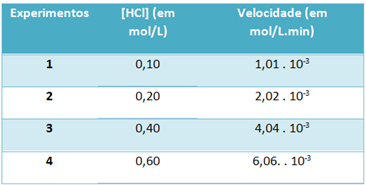
Com base nisso, determine a constante de velocidade característica dessa reação na temperatura mencionada.
Resolução:
a) v = k . [HCl]2
b) v = k . [HCl]2
k = __v___
[HCl]2
k = 1,01 . 10-3 mol . L-1 . min-1
0,01 mol . L-1
k = 1,01 . 10-1 min-1
Para resolver a letra “b”, podem-se usar os dados de qualquer uma das experiências que o valor obtido será o mesmo.
Mas, e se a reação não for elementar? Como será possível resolver questões semelhantes a essas em reações não elementares? Para saber como, leia o texto Lei da velocidade para reações não elementares.
Por Jennifer Fogaça
Graduada em Química