A isomeria geométrica ou cis-trans é um tipo de isomeria espacial, também denominada de estereoisomeria e, portanto, os compostos que apresentam esse tipo de isomeria são chamados de esteroisômeros. Ela só ocorre em moléculas alifáticas (de cadeia aberta) que possuem dupla ligação ou em compostos cíclicos.
Não pare agora... Tem mais depois da publicidade ;)
Nos compostos de cadeias abertas insaturadas, se os átomos que se ligam aos carbonos da dupla forem diferentes entre si e iguais aos ligantes do outro átomo de carbono, teremos a formação de dois compostos isômeros entre si, um cis e outro trans.
Para determinar se um esteroisômero é cis ou trans é necessário saber a disposição espacial dos átomos que constituem suas moléculas.
Vejamos o exemplo do 1,2-dicloro-etileno:
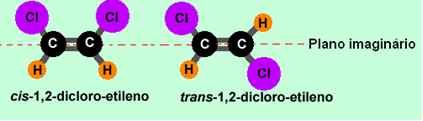
Observe que no primeiro caso os ligantes iguais estão do mesmo lado do plano, sendo isômeros cis. Já na segunda molécula, os ligantes iguais estão em lados opostos do plano, sendo, portanto, isômeros trans.
Essa diferença da localização espacial de seus átomos faz com que o composto cis possua propriedades diferentes de seu isômero trans.
Portanto, conclui-se que nos compostos alifáticos (de cadeia aberta), para que a isomeria geométrica cis-trans ocorra, é necessário que o composto apresente pelo menos uma dupla ligação entre carbonos e cada um dos carbonos da dupla deve apresentar grupos ligantes diferentes.
Mas, se todos os ligantes forem diferentes, como saber qual será cis e qual será trans?
Nesse caso, considera-se o número atômico dos ligantes. Se os dois ligantes que apresentarem maiores números atômicos estiverem do mesmo lado do plano, o isômero será cis. Porém, se eles estiverem em lados opostos, será denominado isômero trans.
Por exemplo, no caso da molécula do 2-cloro-2-buteno, no primeiro carbono o ligante de maior número atômico é o Cl, e no segundo carbono o ligante de maior número atômico é o CH3. Assim, temos:
Cl CH3 Cl H
│ │ │ │
C ═ C C ═ C
│ │ │ │
H3C H H3C CH3
Cis-2-cloro-2-buteno Trans-2-cloro-2-buteno
Para saber como esse tipo de estereoisomeria ocorre em compostos cíclicos, leia o texto: “Isomeria geométrica cis-trans em compostos cíclicos”
Por Jennifer Fogaça
Graduada em Química



.jpg)