Fórmulas estruturais do carbono são representações gráficas essenciais no campo da Química Orgânica. Por meio delas, compostos tridimensionais são representados bidimensionalmente, demonstrando a forma com que os átomos se unem por meio das ligações covalentes em diversos compostos.
As fórmulas estruturais podem ser, basicamente, de três tipos: convencional, condensada e em bastão. Elas são diferenciadas de acordo com a complexidade e informação visível, possuindo vantagens e desvantagens a depender do uso.
Leia também: Quais são as classificações do carbono?
Tópicos deste artigo
- 1 - Resumo sobre fórmulas estruturais do carbono
- 2 - O que é fórmula estrutural?
- 3 - Quais são as fórmulas estruturais do carbono?
- 4 - Evolução das fórmulas estruturais do carbono
- 5 - Fórmula molecular do carbono
Resumo sobre fórmulas estruturais do carbono
- Fórmulas estruturais do carbono são representações gráficas essenciais no campo da Química Orgânica.
- Elas representam compostos orgânicos tridimensionais de forma bidimensional, demonstrando as ligações exercidas pelos átomos ali presentes.
- Em Química Orgânica, são comumente usadas três fórmulas estruturais: a convencional, a condensada e em bastão.
- A fórmula estrutural convencional apresenta todos os átomos presentes na molécula.
- A fórmula estrutural condensada apresenta a aglutinação dos átomos de hidrogênio, muito numerosos em compostos orgânicos, aos átomos de carbono, tendo um melhor efeito visual.
- A fórmula estrutural em bastão é uma representação minimalista dos compostos orgânicos, omitindo os carbonos e os hidrogênios e dando maior protagonismo para as ligações.
- Apesar de a fórmula molecular ser uma forma de representação de compostos muito importante para cálculos de massa, ela não é capaz de diferenciar isômeros, e por isso não se aconselha utilizá-la para diferenciar compostos que possuem o carbono como principal elemento químico.
O que é fórmula estrutural?
Uma fórmula estrutural é uma representação gráfica bidimensional de uma molécula, demonstrando como os átomos se unem por meio das ligações químicas. No caso específico do carbono, as fórmulas estruturais são muito importantes, pois o carbono é o elemento central da Química Orgânica. Embora existam compostos inorgânicos de carbono (como é o caso dos carbetos, por exemplo), a compreensão estrutural do carbono só interessa para os compostos orgânicos, uma vez que a variabilidade de ligações é grande com a possibilidade de realização de quatro ligações covalentes.
Quais são as fórmulas estruturais do carbono?
A atenção às fórmulas estruturais do carbono se limita ao campo dos compostos orgânicos, estudados na Química Orgânica. Dentro dessa área do conhecimento, os tipos de fórmulas estruturais do carbono usadas são:
- fórmula estrutural convencional;
- fórmula estrutural condensada;
- fórmula estrutural em bastão.
Essas fórmulas se diferem na sua representação. Entenda melhor sobre essas diferenças a seguir.
→ Fórmula estrutural convencional
No caso da fórmula estrutural convencional, representam-se, além do carbono, todos os átomos e ligações covalentes da molécula, conforme é possível perceber na imagem a seguir.
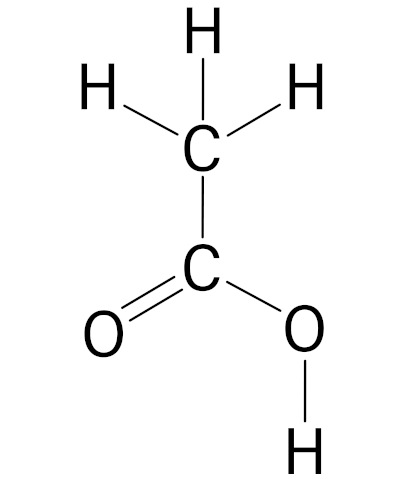
A vantagem dessa fórmula é que é possível identificar, em primeiro plano, todos os átomos e ligações covalentes (sigma ou pi) da molécula. Contudo, como desvantagem, essa representação apresenta maior poluição visual, muito por conta do grande número de átomos de hidrogênio presentes, principalmente em moléculas maiores. Vale lembrar que o carbono faz quatro ligações covalentes, e, muitas das vezes, é o átomo de hidrogênio que completa as valências (agindo como um “tapa-buraco”).
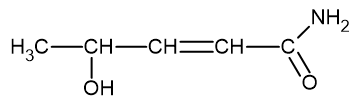
→ Fórmula estrutural condensada
Outra forma de representação é por meio da condensação dos átomos de hidrogênio na fórmula estrutural, na chamada fórmula estrutural condensada. Nessa fórmula, os átomos de hidrogênio são aglutinados ao lado do átomo de carbono e a sua quantidade é indicada em um índice sobrescrito.
→ Fórmula estrutural em bastão
Diante da complexidade e variedade das estruturas orgânicas, destaca-se, pela praticidade, a representação de estruturas de carbono por meio da fórmula estrutural em bastão. Nesse modelo, que preza pelo minimalismo, apenas as ligações químicas são representadas, omitindo-se os dois principais átomos dos compostos nesses compostos: o carbono e o hidrogênio, salvo quando estes forem importantes para representar um grupo importante ou uma função orgânica. Átomos diferentes, como oxigênio e nitrogênio, os quais são menos frequentes em Química Orgânica, entretanto são representados normalmente.
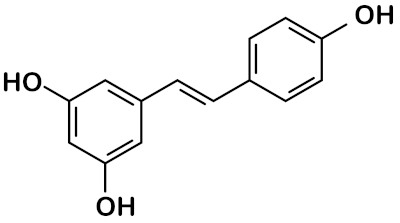
Percebe-se, no composto acima, a representação de átomos de hidrogênio ligados ao átomo de oxigênio. Neste caso, mesmo em bastão, admite-se a representação do hidrogênio dada sua importância para identificação do grupo funcional hidroxila.
Veja também: Cadeias carbônicas — as estruturas básicas dos compostos orgânicos
Evolução das fórmulas estruturais do carbono
As fórmulas estruturais atuais são baseadas nas estruturas de Lewis, desenvolvidas pelo cientista Gilbert Newton Lewis, em 1916.
Contudo, a Química Orgânica já se desenvolvia desde o século XIX, antes de Lewis desenvolver seus trabalhos. Assim, a demanda por representar fórmulas estruturais do carbono já existia mesmo antes dos trabalhos de Lewis.
Nesse sentido, a primeira forma de representação que se conhece de compostos de carbono é por meio dos trabalhos do alemão Friedrich August Kekulé, por volta de 1860. Tal estrutura é conhecida como “fórmulas de salsicha”, pois átomos com valência maior do que 1, como oxigênio e carbono, eram representados por lóbulos ovais.
Fórmula molecular do carbono
Uma outra forma de representar compostos se dá pela fórmula molecular, a qual apresenta o número de átomos de cada elemento presente em uma molécula. Por exemplo, o ácido etanoico possui fórmula molecular C2H4O2, enquanto o octano possui fórmula molecular C8H18. Tal fórmula é muito útil para o cálculo da massa molecular (ou molar) de determinado composto, mas nem sempre é muito útil em estudos de Química Orgânica.
Isso porque é comum a existência de compostos isômeros, ou seja, compostos diferentes, mas que possuem a mesma fórmula molecular. A fórmula C8H18, antes citada para se referir ao octano, também é a mesma para diversos compostos diferentes de oito carbonos, como as estruturas de metil-heptano, dimetil-hexano e trimetilpentano. Dessa forma, não se aconselha diferenciar compostos orgânicos, que são compostos que apresentam o carbono como principal elemento químico, pela sua fórmula molecular.
Fontes
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, v. 66, n. 5, p. 1077-1184, 1994.
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.
SUTTON, M. Snakes, sausages and structural formulae. Chemistry World. 08 out. 2015. Disponível em: https://www.chemistryworld.com/features/snakes-sausages-and-structural-formulae/9038.article.


