A Teoria das Colisões explica os choques entre átomos e moléculas presentes em um meio material e é um fator fundamental para a ocorrência de uma reação química. Ela foi proposta pelos químicos Max Trautz e William Lewis, no início do século XX, e afirma que a ocorrência de uma reação química depende de uma colisão (choque efetivo) eficaz entre as partículas dos reagentes por meio de uma orientação favorável e com uma energia maior do que a energia mínima (energia de ativação) necessária para a ocorrência da reação.
Tópicos deste artigo
- 1 - Energia de ativação
- 2 - Choques eficazes (orientação favorável) ou choques efetivos
- 3 - Choques ineficazes (orientação desfavorável) ou choques inefetivos
- 4 - Fatores que ampliam a colisão entre as partículas
- 5 - Resumo
- 6 - Exercícios resolvidos sobre Teoria da Colisão
- 7 - Resolução
- 8 - Resolução
Energia de ativação
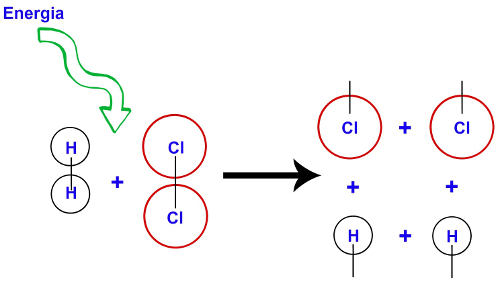
É a energia mínima necessária para que, quando duas moléculas choquem-se, com uma orientação favorável (choque efetivo), haja o rompimento das ligações entre os átomos das partículas. Veja o esquema a seguir:
Após o rompimento das ligações entre os átomos dos reagentes, ocorre ainda a formação de um complexo que abrange os átomos que formavam as moléculas dos reagentes, o qual é denominado de complexo ativado.
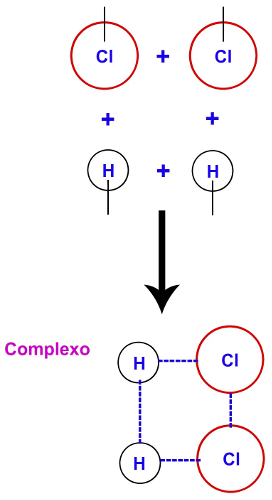
Representação da formação do complexo ativado
A energia de ativação é obrigatória até a formação do complexo ativado. A partir dele, há a formação dos produtos.
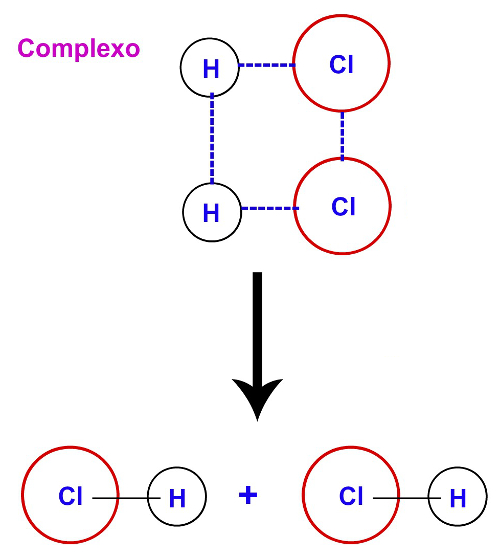
Formação do produto a partir do complexo ativado.
Choques eficazes (orientação favorável) ou choques efetivos
Temos um choque eficaz entre as partículas dos reagentes quando ele é bem orientado (todos os átomos de uma molécula chocam-se com os átomos da outra molécula) e com energia suficiente para romper as ligações entre os átomos das partículas.
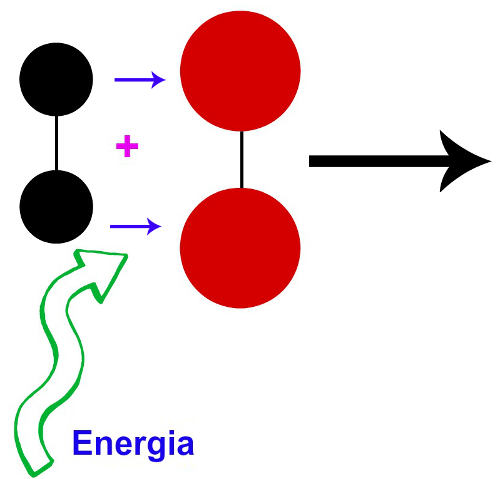
Moléculas de dois gases quaisquer com orientação favorável, resultando em um choque efetivo
Na imagem, as setas em azul indicam que cada átomo de uma molécula choca-se com cada átomo da outra molécula.
Choques ineficazes (orientação desfavorável) ou choques inefetivos
Se a orientação não for favorável, o choque não será eficaz, pois não será suficiente para o rompimento das ligações dos reagentes. Observe a imagem a seguir:
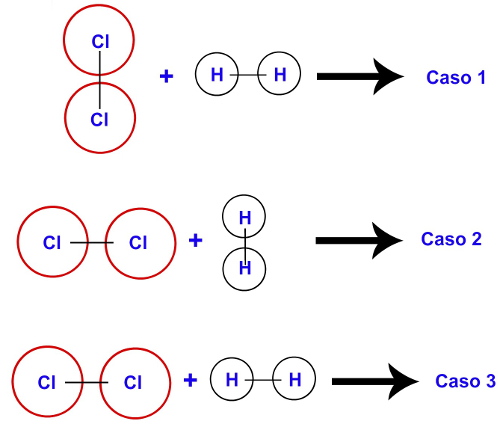
Moléculas dos gases H2 e Cl2 com orientação desfavorável
-
Caso 1: o choque é ineficaz porque cada átomo de cloro só é capaz de atingir um dos átomos de hidrogênio;
-
Caso 2: o choque é ineficaz porque cada átomo de hidrogênio só é capaz de atingir um dos átomos de cloro;
-
Caso 3: o choque é ineficaz porque um átomo de hidrogênio é capaz de atingir apenas um átomo de cloro.
Veja também: Velocidade das reações químicas
Fatores que ampliam a colisão entre as partículas
Temperatura
Quando aquecemos o meio reacional, automaticamente o calor é transferido para as moléculas em seu interior, as quais passam a se deslocar com uma velocidade maior, por apresentarem mais energia, logo, a frequência das colisões entre as partículas dos reagentes também é maior.
Veja também: Superfície de contato e velocidade das reações
Pressão
Quando aquecemos o meio reacional (principalmente se no interior dele estiverem materiais gasosos), automaticamente a pressão desse meio ficará maior, ampliando a frequência das colisões entre as partículas dos reagentes.
Resumo
-
Energia de ativação é a energia necessária para a formação do complexo ativado;
-
Complexo ativado é um composto intermediário fundamental para a formação do produto;
-
Colisões efetivas são aquelas que ocorrem entre moléculas com orientações favoráveis para a quebra do máximo de ligações possíveis nos reagentes;
-
A temperatura pode aumentar ou diminuir a energia cinética das moléculas e, consequentemente, os choques entre elas;
-
A pressão pode aumentar ou diminuir a energia cinética das moléculas e, consequentemente, os choques entre elas.
Exercícios resolvidos sobre Teoria da Colisão
Exemplo 1: (Ufla) A velocidade de uma reação química depende:
I. do número de colisões entre as moléculas na unidade de tempo.
II. da energia cinética das moléculas envolvidas na reação.
III. da orientação das moléculas.
Estão corretas as alternativas:
a) I, II e III
b) somente I
c) somente II
d) somente I e II
e) somente I e III
Resolução
A resposta para a questão é a alternativa a, pois:
I. Verdadeira. Quanto maior o número de colisões entre os reagentes, mais ligações químicas são rompidas e mais rapidamente o complexo ativado e o produto são formados.
II- Verdadeira. Quanto maior a energia cinética, mais as moléculas chocam-se umas com as outras.
III- Verdadeira. Quanto melhor é a orientação do choque entre as moléculas, mais ligações são rompidas.
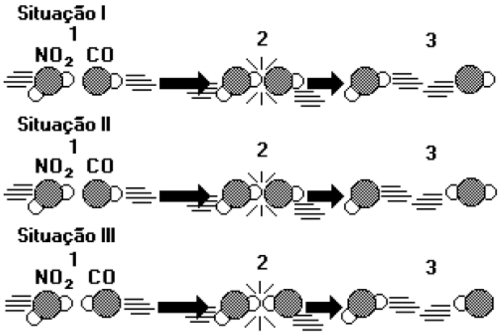
Exemplo 2: (UFRS) As figuras a seguir representam as colisões entre as moléculas reagentes de uma mesma reação em três situações.
Dica: A reação em questão é NO2 + CO → NO + CO2
Pode-se afirmar que:
a) na situação I, as moléculas reagentes apresentam energia maior que a energia de ativação, mas a geometria da colisão não favorece a formação dos produtos.
b) na situação II, ocorreu uma colisão com geometria favorável e energia suficiente para formar os produtos.
c) na situação III, as moléculas reagentes foram completamente transformadas em produtos.
d) nas situações I e III, ocorreram reações químicas, pois as colisões foram eficazes.
e) nas situações I, II e III, ocorreu a formação do complexo ativado, produzindo novas substâncias.
Resolução
A resposta é a alternativa b.
I- Situação demonstra choque eficiente entre as moléculas, pois o maior átomo de uma molécula colide com mais átomos da outra, mas não resulta em compostos invertidos aos dos reagentes;
II- Situação de choque eficiente entre as moléculas, pois o maior átomo de uma molécula colide com mais átomos da outra, resultando em compostos invertidos aos dos reagentes;
III- Situação de choque não muito eficiente, pois o menor átomo de uma molécula choca-se com o maior átomo da outra, e não todos ao mesmo tempo.
Por Me. Diogo Lopes Dias