PUBLICIDADE
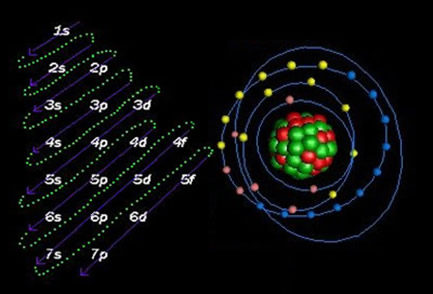
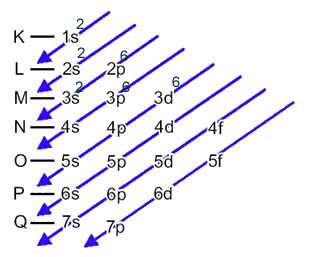
A distribuição eletrônica dos elétrons de um átomo no estado neutro ou fundamental é comumente realizada com o diagrama de Pauling, mostrado abaixo:
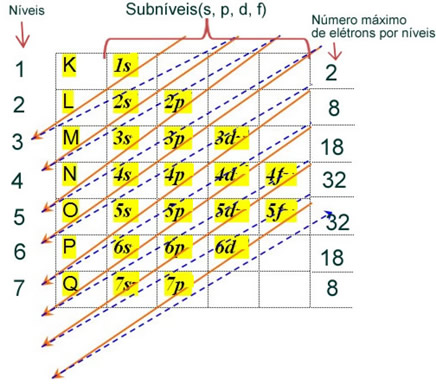
As regras detalhadas dessa distribuição podem ser encontradas nos dois textos seguintes em nosso site: “Distribuição eletrônica de elétrons” e “Regras de distribuição eletrônica”.
A distribuição eletrônica de íons funciona inicialmente da mesma forma que a feita para átomos no estado neutro; com apenas uma diferença. Visto que um íon é um átomo que ganhou ou perdeu elétrons, devemos levar isso em consideração e fazer o seguinte:

Uma observação importante é: a alteração é feita no subnível mais externo e não no mais energético.
Se o íon for um cátion, devemos retirar os elétrons que ele perdeu. Vejamos um exemplo:
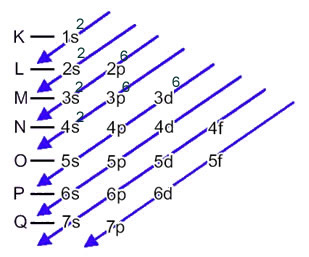
O átomo de ferro (número atômico = 26) tem a seguinte distribuição eletrônica nos subníveis em ordem energética: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Já quanto às camadas eletrônicas, temos: K = 2; L = 8; M = 14; N = 2.
Essa distribuição é mostrada no diagrama de Pauling abaixo:
Quando o átomo de ferro perde 2 elétrons, ele se transforma no cátion Fe2+. Assim, ao fazer a sua distribuição eletrônica temos que retirar 2 elétrons da última camada (N) e não do subnível mais energético, conforme mostrado abaixo:
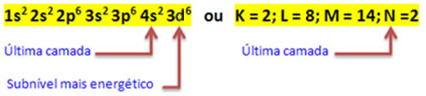
Desse modo, a distribuição eletrônica do cátion Fe2+ é dada por:
1s2 2s2 2p6 3s2 3p6 3d6 ou K = 2; L = 8; M = 14
Agora, se tivermos que realizar a distribuição eletrônica de um ânion, devemos acrescentar os elétrons que ele recebeu.Veja como se faz isso no exemplo a seguir:
O ânion enxofre (16S2-) é formado a partir do átomo de enxofre (16S) pelo ganho de 2 elétrons, conforme indicado pela carga 2-. Sua distribuição eletrônica no estado fundamental é dada por:
1s2 2s2 2p6 3s2 3p4 ou K = 2; L = 8; M = 6
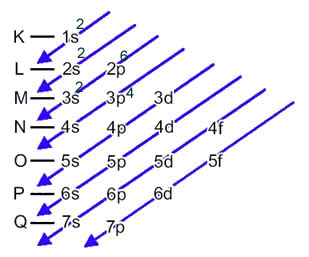
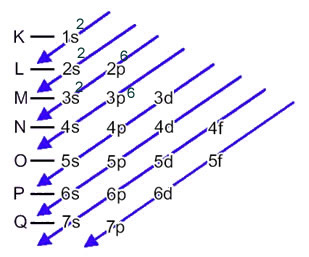
Nesse caso, o último subnível é o mesmo que o subnível energético, o 3p. Assim, acrescentamos nele os dois elétrons do ânion enxofre:
1s2 2s2 2p6 3s2 3p6 ou K = 2; L = 8; M = 8
Por Jennifer Fogaça
Graduada em Química