PUBLICIDADE
No texto “Concentração em mol/L ou Molaridade” você viu que a concentração em mol/L relaciona a quantidade de matéria do soluto (n1, medido em mols) com o volume da solução em litros (V). No entanto, existem alguns solutos que ao serem colocados na água originam íons.
Um exemplo é quando colocamos o sal (NaCl) na água, ocorrendo uma atração entre o polo positivo da água com o Cl e o polo negativo com o Na, dando origem aos íons Na+ e Cl-.
.jpg)
É importante saber determinar a concentração em mol/L desses íons, pois isso pode ser útil em várias situações. Uma área que utiliza isso é a medicina, principalmente em exames médicos de sangue. O nosso sangue e outros fluidos corpóreos possuem íons dissolvidos neles. Se a concentração desses íons em nosso sangue estiver acima ou abaixo do normal, pode comprometer o bom funcionamento do nosso organismo e levar a distúrbios e doenças.
Veja o caso dos íons ferro (Fe2+): se a pessoa estiver com carência desse íon, ela pode desenvolver anemia. Assim, quando se diz a alguém que tem anemia que ela precisa consumir comidas ricas em ferro ou mesmo algum medicamento com ferro, na verdade é o íon ferro e não o elemento metálico.
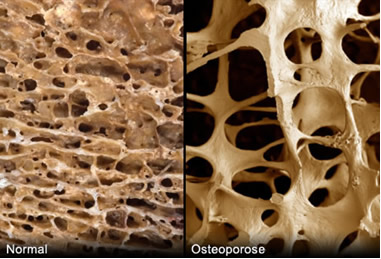
Outro caso é quando há perda de íons cálcio (Ca2+) nos ossos, causando osteoporose, como mostram as fotos com imagens ampliadas de ossos a seguir:
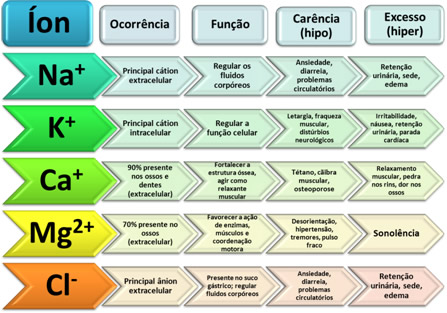
Observe outros exemplos de íons que possuem funções vitais em nosso corpo e que precisam estar na concentração correta:
Portanto, diante dessas informações, torna-se evidente que saber calcular a concentração do íons em soluções é realmente importante. Mas como isso pode ser feito?
É possível determinar as concentrações em mol/L dos íons presentes em soluções se forem conhecidos dois dados essenciais, que são:
- As fórmulas das substâncias dissolvidas em água;
- A molaridade de suas soluções.
Com esses dados em mãos, escreve-se a equação de dissociação ou de ionização do soluto em questão e encontra-se por dedução a concentração dos íons, pois ela é proporcional ao número de mol de cada íon. Isso significa que a concentração dos íons é proporcional aos seus respectivos coeficientes na equação de ionização ou de dissociação.
Veja o exemplo a seguir para entender melhor como é realizado esse cálculo:
“Considere que a concentração em quantidade de matéria de determinada solução aquosa de fosfato de magnésio (Mg3(PO4)2 é 0,5 mol/L. Qual será a concentração em mol/L dos cátions magnésio (Mg2+(aq)) e dos ânions fosfato (PO3-4(aq)) nessa solução, considerando que o grau de dissociação (α) foi de 100%?”
O primeiro passo para resolver esse problema é escrever a equação de dissociação ou ionização. Se tiver dificuldade, você pode se basear na equação genérica abaixo:
1 AxBy → x A+y + y B-x
1 mol x mol y mol
Assim, considerando nesse exemplo que o fosfato de magnésio dissociou totalmente, temos a seguinte equação:
1 Mg3(PO4)2(aq) → 3 Mg2+(aq) + 2 PO3-4(aq)
1 mol 3 mol 2 mol
Podemos perceber que 1 mol de Mg3(PO4)2 origina 3 mol de Mg2+(aq) e 2 mol de PO3-4(aq); assim, o número de mol do cátion será 3 vezes o número de mol do fosfato com que foi preparada a solução, e o do ânions será 2 vezes.
Como a solução é 0,5 mol/L de Mg3(PO4)2(aq) , isso quer dizer que em 1 L dela foi dissolvido 0,5 mol de Mg3(PO4)2, que originou 1,5 mol/L de Mg2+(aq) e 1,0 mol/L de PO3-4(aq):
1 Mg3(PO4)2(aq) → 3 Mg2+(aq) + 2 PO3-4(aq)
1 mol 3 mol 2 mol
0,5 mol x y
1 . 0,5 3 . 0,5 2 . 0,5
0,5 mol/L 1,5 mol/L 1,0 mol/L
Mas e se o grau de dissociação ou ionização não fosse de 100%? Digamos que fosse de 70%, como faríamos para descobrir a concentração em mol/L desses íons?
Nesse caso, basta realizar uma regra de três simples. Veja abaixo:
1,5 mol/L de Mg2+(aq) ---------------- 100 %
x------------------------ 70%
x = 70 . 1,5 → x = 1,05 mol/L de íons Mg2+(aq)
100
1,5 mol/L de PO3-4(aq)---------------- 100 %
y------------------------ 70%
y = 70 . 1,0 → y = 0,70 mol/L de íons PO3-4(aq)
100
Por Jennifer Fogaça
Graduada em Química







