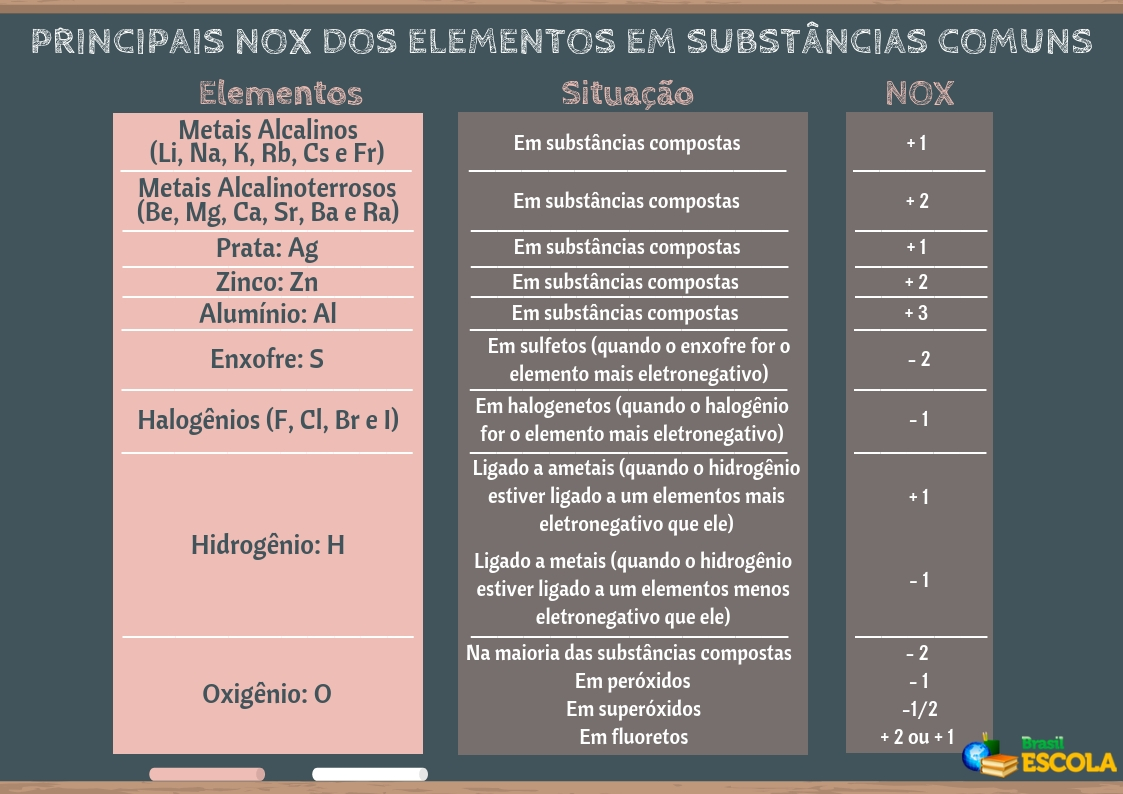
Para os compostos iônicos, o Número de Oxidação (Nox) representa a própria carga que o íon adquire ao realizar a ligação iônica. Por exemplo, o cloreto de sódio é um composto iônico, formado quando o sódio perde um elétron para o cloro; assim, o sódio se torna um cátion com carga elétrica de +1, e o cloro um ânion com carga -1. Esses valores constituem seus respectivos Nox.
Não pare agora... Tem mais depois da publicidade ;)
No entanto, os compostos moleculares não perdem nem recebem elétrons, portanto, o seu Nox é considerado como a carga elétrica teórica que o elemento adquiriria se a ligação covalente fosse rompida e o par de elétrons ficasse com o elemento mais eletronegativo. Por exemplo, no caso do ácido clorídrico (HCl), o cloro é o elemento mais eletronegativo, assim ele atrairia mais fortemente para si o par de elétrons compartilhado com o hidrogênio. Desse modo, teremos que o Nox do cloro será -1 (porque ele ficou com um elétron a mais que era do hidrogênio) e o do hidrogênio é igual a +1 (porque o hidrogênio perdeu um elétron para o cloro).
* Acesse o PDF para impressão!
Assim, podemos fazer a seguinte definição:

No caso dos íons simples, o Nox equivale à sua própria carga elétrica. Por exemplo:
O2-: Nox = -2
Cl-: Nox = -1
Na+: Nox = +1
Fe2+: Nox = +2
Al3+: Nox = +3
Por fim, no caso de um elemento ou de substâncias simples, que são aquelas compostas de átomos de apenas um tipo de elemento, temos que o Nox é igual a zero. Alguns exemplos e substâncias assim são: O2, N2, H2, He, etc.
Além disso, o Nox indica a tendência que o elemento tem de se oxidar ou reduzir, pois quando ocorre a oxidação (perda de elétrons), o Nox aumenta. Já no caso da redução (ganho de elétrons), ocorre o contrário, o Nox diminui. Para visualizar esse caso, observe a reação de oxirredução de formação do gás carbônico abaixo:
0 0 +4-2
Cn(s) + n O2(g) → n CO2(g)
Observe que por serem um elemento (C) e uma substância simples (O2), os Nox dos reagentes eram iguais a zero. Porém, depois da reação, o carbono sofreu oxidação, assim, observe como seu Nox aumentou (de 0 para +4). Já o oxigênio sofreu redução, portanto, seu Nox diminuiu, indo de 0 para -2.
Por Jennifer Fogaça
Graduada em Química