PUBLICIDADE
O pH de uma solução indica o teor (medida) de íons hidrônio (H3O+) presente no meio. Esse teor determina se a solução analisada apresenta caráter ácido, básico ou neutro.
Observação: Vale ressaltar que o teor de hidrônio (H3O+ ou H+) pode ser adquirido de forma simples em laboratório por meio de fitas indicadoras de pH – que, no entanto, não apresentam uma grande precisão na medida – ou por meio de um equipamento denominado de peagâmetro, que, ao contrário, apresenta uma grande precisão na medida do pH de uma solução.

Peagâmetro ou potenciômetro para medir o pH de uma solução
Para realizar os cálculos envolvendo o pH de uma solução, podemos utilizar a seguinte equação logarítmica:
pH = - log [H3O+]
ou
pH = - log [H+]
IMPORTANTE: Nos cálculos envolvendo o pH de uma solução, sempre utilizamos logaritmo de base 10.
Tópicos deste artigo
Mapa Mental: Cálculo do PH de Soluções

* Para baixar o mapa mental em PDF, clique aqui!
A partir da equação logarítmica acima, podemos ainda utilizar a seguinte simplificação (obtida por aplicação de função logarítmica) dessa equação:
[H3O+] = 10-pH
Observação: A expressão simplificada acima só poderá ser utilizada se o valor do pH for inteiro; caso contrário, a função logarítmica deverá ser utilizada.
É importante ressaltar que os cálculos envolvendo o pH de uma solução estão sempre relacionados com o pOH (potencial hidroxiliônico/ OH-), já que ambos os potencias baseiam-se na autoionização da água (Kw = 10-14, fenômeno no qual a água produz tanto H+ quanto OH-) e na lei da diluição de Ostwald (quanto mais diluída uma solução, maior a quantidade de cátions H+ ). Assim:
-
em relação à autoionização da água:
Kw = [H+] . [OH-], por isso pH + pOH = 14
-
lei de diluição de Ostwald (por meio dela, podemos saber quanto um determinado material ioniza-se ou se dissocia na água):
Ki = M.α2
Ki = Contante de ionização de uma substância em meio aquoso;
M = molaridade ou concentração molar da substância no meio aquoso;
α2 = grau de ionização ou dissociação do material no meio.
A classificação de uma solução em ácida, básica ou neutra terá os seguintes critérios (a 25 oC):
-
uma solução será neutra quando a concentração de H+ for igual à concentração de OH- ou ter pH igual a 7.
Não pare agora... Tem mais depois da publicidade ;)
[H+] = [OH-]
-
uma solução será ácida quando a concentração de H+ for maior que a concentração de OH- ou o pH estiver entre 0 e 7.
[H+] > [OH-]
-
uma solução será básica quando a concentração de H+ for menor que a concentração de OH- ou o pH estiver entre 7 e 14.
[H+] < [OH-]
Veja alguns exemplos de cálculos envolvendo o pH de soluções:
1º) Sabendo que a concentração de hidrônio em um cafezinho é igual a 1.10-5, qual será o pH presente nessa solução?
Como o exercício forneceu a concentração de hidrônios no cafezinho, podemos utilizar a fórmula simplificada do pH:
[H3O+] = 10-pH
1.10-5 = 10-pH
10-5 = 10-pH
-5 = -pH
pH = 5
Como o pH é menor que 7, a solução é ácida.
2º) (UFU) Qual o pH de uma solução 0,045 mol/L de ácido acético, supondo que o seu Ki = 1,.10-5? Dados: log 2 = 0,3; log 3 = 0,48.
Dados do exercício:
M = 0,045 mol/L
Ki = 1,8.10-5
log 2 = 0,3
log 3 = 0,48
Como o exercício forneceu a molaridade (M) e a constante de ionização (Ki), inicialmente vamos determinar o grau de ionização do ácido mencionado, pois a concentração de hidrônio (H3O+ ou H+) é sempre o resultado da multiplicação entre a molaridade e o grau de ionização. Logo:
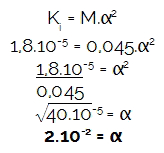
Em seguida, vamos calcular a quantidade de hidrônio multiplicando a molaridade do ácido pelo grau de ionização encontrado:
[H3O+] = M.α
[H3O+] = 0,045.2.10-2
[H3O+] = 0,09.10-4
[H3O+] = 9.10-4 mol/L
Por fim, colocamos o valor da concentração do hidrônio na equação logarítmica do pH:
pH = - log [H3O+]
pH = - log 9.10-4
pH = 4 – log 9
pH = 4- log 32
pH = 4 – 2. (log 3)
pH = 4- (2.0,48)
pH = 4- 0,96
pH = 3,04
Como o pH é menor que 7, a solução é ácida.
3º) (Cefet-PR) A 45 oC, o Kw de uma solução neutra é igual a 4.10-4. Logo, qual será o valor do pH dessa solução nessa temperatura? Dados log 2 = 0,3.
Como o exercício informa que a solução é neutra, logo [H3O+] é igual a [OH-]:

Por fim, colocamos o valor da concentração do hidrônio na equação logarítmica do pH:
pH = - log [H+]
pH = - log 2.10-7
pH = 7 – log 2
pH = 7- 0,3
pH = 6,7
Como o pH é quase 7, a solução é neutra (como indicado no enunciado do exercício) pelo fato de a temperatura ser de 45 oC.
Por Me. Diogo Lopes Dias







.jpg)