PUBLICIDADE
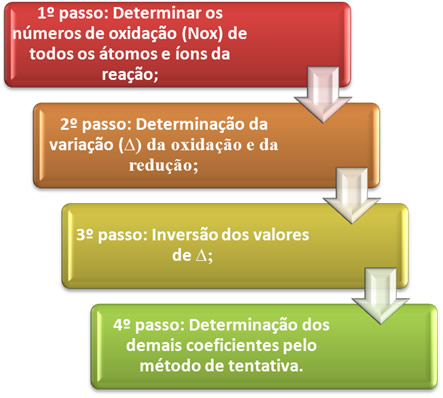
O balanceamento de uma equação de oxirredução se baseia na igualdade do número de elétrons cedidos com o número de elétrons recebidos. Um método simples de se realizar esse balanceamento é dado pelos passos a seguir:
Vejamos na prática como aplicar esses passos, por meio do seguinte exemplo:
Reação entre uma solução aquosa de permanganato de potássio e ácido clorídrico:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*1º passo: Determinar os números de oxidação:
Esse passo é importante porque normalmente não conseguimos visualizar rapidamente quais são as espécies que sofrem oxidação e redução.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*2º passo: Determinação da variação da oxidação e da redução:
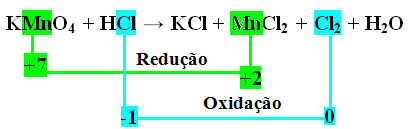
Observe que o manganês (Mn) sofre redução e o cloro (Cl) sofre oxidação.
MnCl2 = ∆Nox = 5
Cl2 = ∆Nox = 2
No caso do cloro, podemos notar que o HCl originou 3 compostos (KCl, MnCl2, e Cl2), mas o que nos interessa é o Cl2, pois é o seu Nox que sofreu variação. Cada cloro que forma Cl2 perde 1 elétron; como são necessários 2 cloros para formar cada Cl2, são perdidos então dois elétrons.
3º passo: Inversão dos valores de ∆:
Nesse passo, os valores de ∆ são trocados entre as espécies citadas, tornando-se os coeficientes delas:
MnCl2 = ∆Nox = 5 → 5 será o coeficiente de Cl2
Cl2 = ∆Nox = 2→ 2 será o coeficiente de MnCl2
KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Nesse momento já é possível conhecer dois coeficientes da equação.
Observação: normalmente, na maioria das reações, essa inversão de valores é efetuada no 1º membro. Mas, como regra geral, isso deve ser feito no membro que tiver maior número de átomos que sofrem oxirredução. Se esse critério não puder ser observado, invertemos os valores no membro que tiver maior número de espécies químicas. Foi isso o que foi realizado aqui, pois o 2º membro possui mais substâncias.
4º passo: Balanceamento por tentativa:
KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Visto que no segundo membro há dois átomos de manganês, conforme mostrado pelo coeficiente, no primeiro também deverá haver. Portanto, temos:
2 KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Com isso, a quantidade de potássio (K) no 1º membro ficou de 2, que será o mesmo coeficiente para esse átomo no segundo membro:
2 KMnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- A quantidade de cloros (Cl) no 2º membro é de 16 no total, por isso o coeficiente do HCl do 1º membro será:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- O número de hidrogênios do 1º membro é 16, por isso o coeficiente da água (H2O) do 2º membro será igual a 8, pois a multiplicação do índice do hidrogênio (2) por 8 é igual a 16:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Para conferir se a equação está corretamente balanceada podemos ver dois critérios:
1º) Verificar se a quantidade de cada átomo nos dois membros está igual:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
K =2 K =2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
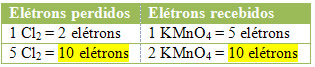
2º) Ver se o número total de elétrons perdidos é igual ao número total de elétrons recebidos:
Por Jennifer Fogaça
Graduada em Química