PUBLICIDADE
Desde a antiguidade o homem se interessa em responder a pergunta sobre a constituição da matéria.
Diversas personalidades da comunidade científica se posicionaram sobre o assunto, mas foi apenas no final do século XIX que os mistérios sobre a composição atômica começaram a ser desvendados.
O antigo filósofo Leucipo, por exemplo, acreditava que o átomo era constituído por partículas minúsculas.
Depois dessa definição, foi proposto por Demócrito e Dalton que as partículas atômicas eram maciças e indivisíveis.
Fato este contestado mais tarde por Thomson, um físico inglês que descobriu a existência do elétron e pôde, então, confirmar a ideia antes proposta por Leucipo.
Depois dessa descoberta, Thomson apresentou um modelo no qual o átomo era formado por uma esfera de cargas positivas e dentro do núcleo existiam elétrons.
.jpg)
Modelo do átomo de Thomson – Numa esfera de massa uniformemente distribuída carregada positivamente,
estariam incrustados elétrons de carga negativa, como em um pudim.
Mesmo depois da teoria de Thomson, o modelo atômico ainda apresentava deficiência teórica-experimental, capaz de comprovar sua veracidade.
O assunto voltou a ser discutido de forma calorosa quando a equipe do físico Rutherford observou que acontecia um desvio muito grande (e inexplicável, segundo a teoria do pudim de passas) quando algumas partículas radioativas alfa atravessavam uma camada fina de lâmina metálica.
Depois de analisar e estudar o fato, Rutherford chegou à conclusão de que o raio do átomo é 10 000 vezes maior que o raio do núcleo.
Através de todo o estudo sobre o átomo, Rutherford e sua equipe chegaram, em 1911, a um modelo atômico, que chamaram de modelo planetário do átomo.
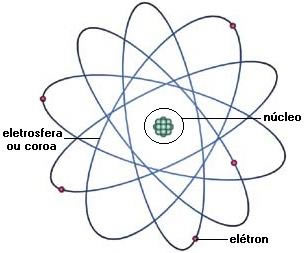
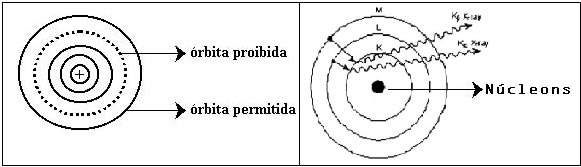
Em 1913, Niels Bohr decifrou o modelo atômico, aplicando aos seus estudos o quantum de ação descoberto por Planck. O quantum de ação era, na verdade, o grande curinga que viria a concluir e esclarecer o modelo atômico.
Bohr ajustou com eficiência e de forma simples o modelo apresentado por Rutherford chegando à seguinte conclusão:
O elétron adquire energia, que é representada através de uma órbita definida. As órbitas permitidas formam os níveis de energia.
Por Talita A. Anjos
Graduada em Física
Equipe Brasil Escola






.jpg)